http://www.intramed.net/home.asp
Autor: Dirkje S. Postma, M.D., Ph.D., and Klaus F. Rabe Fuente: The New England Journal of Medicine The Asthma–COPD Overlap Syndrome
Resumen
El término “síndrome de superposición asma–EPOC” (SAOC) se emplea cuando el paciente tiene características clínicas tanto de asma como de EPOC. En especial en pacientes ancianos, las manifestaciones del asma y la EPOC pueden ser muy similares.
Aún no hay estudios que consideren al SAOC como una entidad. Los autores de este trabajo de revisión creen que es prematuro recomendar la designación de SAOC como una entidad mórbida. Son necesarias más investigaciones para caracterizar mejor a los pacientes y obtener una definición estandarizada de SAOC basada sobre los marcadores que mejor pronostiquen la respuesta terapéutica en cada paciente.
Introducción
Aproximadamente 1 de cada 12 personas en todo el mundo sufre asma o enfermedad pulmonar obstructiva crónica (EPOC).Estas dos entidades, que antes se consideraban como dos enfermedades diferentes, actualmente se reconocen como enfermedades heterogéneas y a menudo superpuestas. El término “síndrome de superposición asma–EPOC” (SAOC) (o ACOS por las sigas del inglés) se emplea cuando una persona tiene características clínicas tanto de asma como de EPOC.
La EPOC, que es progresiva en muchos pacientes, es causada principalmente por el tabaquismo, aunque también la pueden causar el tabaquismo pasivo, la polución ambiental y ciertas exposiciones laborales.
La inflamación de las vías respiratorias es diferente en el asma y en la EPOC. El asma se caracteriza sobre todo por inflamación a predominio de eosinófilos e inflamación que afecta a los linfocitos T auxiliares tipo 2 (Th2).
La EPOC se caracteriza sobre todo por inflamación con abundancia de neutrófilos e inflamación que afecta a los linfocitos CD8. En especial en pacientes ancianos, las manifestaciones del asma y la EPOC pueden ser muy similares. Con el tiempo se desarrolla obstrucción irreversible de las vías respiratorias en algunos pacientes con asma debido a la restructuración de las vías respiratorias, y entonces estos pacientes se asemejan a los que sufren EPOC. En cambio, se puede producir obstrucción de las vías respiratorias reversible en pacientes con EPOC, quienes entonces se asemejarán a los que sufren asma. (Cuadro).
Recientemente, la Global Initiative for Asthma (GINA) y la Global Initiative for Chronic Obstructive Lung Disease (GOLD) publicaron un documento conjunto ( www . ginasthma . org/ local/ uploads/ files/ ACOS_2015 . pdf o www . goldcopd . org/ uploads/ users/ files/GOLD_ACOS_2015 . pdf) que describe al SAOC como una entidad clínica y propone que los médicos reúnan las características del asma y la EPOC que describen al paciente y comparen la cantidad de características que apoyan cada diagnóstico.
En la práctica, si se hallan tres o más características de asma o de EPOC, se sugiere ese diagnóstico; si los números de una y otra son similares, se debe considerar el diagnóstico de SAOC. Las variables importantes son la edad de inicio, las características del comienzo y el curso de los síntomas, los antecedentes personales o familiares, la limitación variable o persistente del flujo aéreo, la función pulmonar entre los síntomas y la distensión pulmonar grave.
Se estima que el SAOC está presente en el 15 - 45% de la población con enfermedad obstructiva de las vías respiratorias y su prevalencia aumenta con la edad. A pesar de esto, no se han efectuado estudios prospectivos doble ciego sobre el tratamiento de estos tipos de pacientes. Es así como no se sabe cuál es el tratamiento más eficaz para los pacientes con SAOC .
La tendencia mundial al aumento de la expectativa de vida aumenta la mediana de edad de la población con asma. Esto aumenta la probabilidad de superposición con la EPOC, definida por el VEM1; la prevalencia estimada de SAOC depende mucho de la edad. Las poblaciones con antecedentes de asma que pueden tener SAOC son pacientes con asma de larga data y los que sufren asma grave.
Hiperrreactividad bronquial:
La hiperreactividad bronquial se considera como patognomónica del asma. No es parte de la definición de asma, porque no distingue concluyentemente el asma de la EPOC. La hiperreactividad bronquial se origina por numerosos factores, como el diámetro reducido de las vías aéreas, el aumento del grosor de la pared de las vías aéreas, el aumento de la masa muscular lisa y el aumento de la reactividad del músculo liso, el aumento de la vascularidad peribronquial, la pérdida de la retracción elástica del pulmón, la inflamación de las vías aéreas, la lesión del epitelio y el aumento de la actividad neurogénica.
En pacientes con asma hay evidencia de que el grado de hiperreactividad bronquial se relaciona con la inflamación eosinófila subyacente y alteraciones fenotípicas y funcionales del músculo liso de las vías aéreas, alteración de la respuesta glucocorticoide, y disfunción de la pequeña vía aérea. Es discutible si la hiperreactividad bronquial se asocia con la disminución acelerada del VEM1 en pacientes con asma, pero estudios mostraron que la hiperreactividad bronquial disminuyó mucho tras 3 meses de tratamiento con glucocorticoides inhalados, que no es el caso en pacientes con EPOC.
La hiperreactividad bronquial también es un factor de riesgo para el desarrollo de EPOC. Su frecuencia entre pacientes con EPOC es del 60%, y puede aparecer incluso en pacientes con enfermedad leve. Un estudio mostró hiperreactividad bronquial en el 90% de los pacientes con EPOC sin antecedentes de asma. Un estudio reciente mostró que la hiperreactividad bronquial más intensa se asocia con mayor volumen residual (una medida del atrapamiento aéreo relacionado con disfunción de la pequeña vía aérea) en la EPOC.
Además, la hiperreactividad bronquial se asocia con inflamación de las vías respiratorias — es decir, mayores valores de neutrófilos, macrófagos y linfocitos en el esputo y en las muestras de biopsia bronquial y mayores valores de linfocitos CD8 y eosinófilos en los tejidos pulmonares periféricos — en pacientes con EPOC. Antes se pensaba que la asociación de aumento de eosinófilos con hiperreactividad bronquial se limitaba sólo al asma.
¿Cuáles son las consecuencias clínicas de la hiperreactividad bronquial en la EPOC?
Estudios mostraron que la disminución del VEM1 se acelera en pacientes con EPOC que tienen hiperreactividad bronquial y que la disminución es mayor aún en los fumadores. Así, la asociación de la hiperreactividad bronquial con la evolución de los cambios de la función pulmonar y con la respuesta a los glucocorticoides inhalados difiere entre la EPOC y el asma.
La hiperreactividad bronquial es un factor de riesgo de muerte por EPOC en la población general. Por ello, la hiperreactividad bronquial es un marcador de enfermedad más grave tanto en el asma como en la EPOC, pero no hay datos suficientes para indicar beneficios alejados con la reducción de la hiperreactividad bronquial, y, de ser así, cómo lograr esto en pacientes que sufren tanto asma como EPOC.
Reversibilidad de la obstrucción de las vías respiratorias:
La reversibilidad de la obstrucción de las vías respiratorias tras la inhalación de un broncodilatador como el albuterol es patognomónica del asma temprana y se la considera como criterio para diferenciar el asma de la EPOC. La reversibilidad puede disminuir o incluso desaparecer con el asma de larga data. Es bien sabido que la función pulmonar se puede normalizar tras la inhalación de broncodilatadores o tras el empleo de glucocorticoides inhalados en formas de asma más leves. En cambio, en el asma más grave, la reversibilidad puede ser limitada; es decir que la falta de reversibilidad total no descarta el diagnóstico de asma.
Con frecuencia también hay reversibilidad de la obstrucción de las vías respiratorias en la EPOC; en dos estudios, se observó reversibilidad en hasta el 44%de los pacientes en uno y el 50% en el otro.
La atopía en el asma y en la EPOC:
La atopía es un factor de riesgo para el asma y la mayoría de las personas con asma son atópicas. El asma alérgica generalmente responde al tratamiento con glucocorticoides inhalados. Los pacientes con EPOC también pueden ser atópicos e incluso es un factor de riesgo para el desarrollo de EPOC. Dos estudios que investigaron la presencia de atopía en cohortes de personas con EPOC mostraron prevalencias del 18% y el 30%, respectivamente.
The European Respiratory Society Study on Chronic Obstructive Pulmonary Disease (EUROSCOP) es un estudio prospectivo aleatorizado, controlado, de la eficacia a largo plazo, de los glucocorticoides inhalados en la EPOC de leve a moderada. Este estudio mostró que aproximadamente el 18% de los pacientes eran atópicos.
La atopía no se asoció significativamente con la gravedad basal de la obstrucción de las vías respiratorias o la velocidad de la diminución del VEM1, pero sí con tos y flemas en los pacientes que recibían placebo. Los pacientes con atopía que recibieron budesonida tuvieron menos de estos síntomas que aquéllos sin atopía. Esta observación coincide con los resultados de un estudio anterior que sugirió que los pacientes con EPOC que sufren atopía son los que más se benefician con los glucocorticoides.
Inflamación de las vías respiratorias en el asma y EPOC:
Se acepta que el asma típicamente tiene un patrón de inflamación eosinófílo y de citocinas producidas por las Th2, mientras la inflamación neutrófila domina en la EPOC. Pacientes con asma que sufren enfermedad grave o de inicio tardío o infecciones crónicas o que fuman también pueden mostrar inflamación neutrófila y células CD8 en las vías aéreas, mientras que antes se creía que ambas eran patognomónicas de la EPOC. Debido a que el número de neutrófilos en las vías respiratorias aumenta con la edad, este patrón inflamatorio puede simular EPOC en personas ancianas con asma.
Datos recientes sugieren que el reclutamiento de eosinófilos depende de varias vías que no son la clásica vía de Th2 — vías que implican las células linfoideas innatas tipo 2, la interleucina-33, la GATA-3 y los receptores para CRTH2. Es importante observar que la ausencia de eosinofilia y la falta de respuesta a los glucocorticoides inhalados en un paciente no descartan el asma.
La expresión genética distintiva de inflamación de Th2 se puede hallar también en la EPOC. Por ejemplo, la interleucina-13 (una citocina Th2) se expresó en más células T en el líquido de lavado broncoalveolar en pacientes con EPOC que en aquéllos sin EPOC. En un subgrupo de pacientes con EPOC, la expresión genética distintiva de inflamación de Th2 aumentó en muestras de biopsia de las paredes de las vías aéreas, igual que en los pacientes con asma.
Estas características de la expresión del gen se asociaron también con inflamación eosinofílica en la EPOC. El perfil Th2, sin embargo, no se asoció con una respuesta del VEM1 a los glucocorticoides inhalados, como en el asma, sino con la disminución de la relación volumen residual/capacidad pulmonar total, un marcador de hiperinsuflación.
En el 15 - 40% de los pacientes con EPOC estable se hallan eosinófilos en el esputo, el lavado broncoalveolar y el tejido pulmonar. La activación de los eosinófilos se asocia con la gravedad de la enfermedad. Los eosinófilos también pueden aumentar en el esputo de los pacientes con exacerbaciones de la EPOC. En el estudio ECLIPSE, el 37,4% de los 1483 pacientes con EPOC tuvieron eosinofilia persistente en sangre (>2%) durante 3 años de seguimiento.
En otro estudio, los pacientes con EPOC que tenían mayor eosinofilia, aunque la mayoría dentro de lo normal, mantuvieron los valores de VEM1 durante el seguimiento, mientras que aquéllos con valores de eosinófilos menores tuvieron disminuciones aceleradas en el VEM1 posbroncodilatador.
Los pacientes con asma o EPOC que tienen eosinofilia en el esputo tienen mejor respuesta a los glucocorticoides inhalados que aquéllos sin eosinofilia. El tratamiento con glucocorticoides inhalados para reducir la eosinofilia en pacientes con EPOC previene las exacerbaciones y las hospitalizaciones y los glucocorticoides son eficaces para tratar las exacerbaciones que se acompañan con eosinofilia. Estos datos sugieren que la inflamación eosinófila en sangre, esputo o tejido pulmonar significa un endotipo de EPOC con enfermedad más grave, que se refleja en las exacerbaciones, pero menos grave cuando se la evalúa según la disminución del VEM1.
Oxido nítrico exhalado en el asma:
El óxido nítrico exhalado (FeNO) puede ser útil para el diagnóstico de asma. Los valores de FeNO son menores en fumadores que en no fumadores y por eso las determinaciones de FeNO no son tan útiles para diferenciar el asma de la EPOC. Las cifras de FeNO se asocian con eosinofilia en esputo y sangre en el asma; no se sabe si esto es así en la EPOC. Aunque los valores de FeNO en pacientes con asma pueden disminuir notablemente tras el tratamiento con glucocorticoides inhalados, algunos pacientes tienen aumentos persistentes a pesar de este tratamiento. En estos casos puede haber vías operativas distintas a la clásica vía de los Th2.
¿Es el SAOC importante para la práctica médica?
Aunque las superposiciones entre asma y EPOC constituyen una realidad, los documentos GINA y GOLD no proporcionaron una definición específica de SAOC y afirmaron que es necesaria más evidencia sobre “fenotipos clínicos y mecanismos subyacentes”. El peligro de considerar que el SAOC es una entidad mórbida es que se pueden borronear los límites entre asma y EPOC, porque no existen investigaciones que estudien específicamente la población con SAOC, o que puede generar sobretratamiento, en especial con glucocorticoides inhalados.
Otro problema es que se aplican diferentes definiciones de SAOC en diversos estudios. Se impiden así conclusiones firmes sobre la gravedad, el tratamiento y el pronóstico del mismo. Por eso es casi imposible determinar el tratamiento más eficaz para cada paciente. Los autores sugieren la caracterización fenotípica exhaustiva de cada paciente antes de incluirlos en los estudios.
Tratamiento actual del asma y la EPOC
Los documentos GINA y GOLD proporcionan planes terapéuticos bien definidos para los casos claros de asma y EPOC. Por ejemplo, para el paciente con asma “fácil” (véase Cuadro arriba), se recomienda un enfoque escalonado sobre la base de la gravedad de la enfermedad, con el objetivo de mejorarla y de controlar el riesgo a futuro. Los pilares del tratamiento son los glucocorticoides inhalados junto con broncodilatadores, en especial beta-agonistas de acción corta y beta- agonistas de acción prolongada (BAAP). Los antagonistas de los receptores de leucotrieno son otra alternativa cuando la enfermedad es más leve.
Para el asma alérgica grave con valores apropiados de IgE, el tratamiento anti-IgE es una opción aprobada. En estudios controlados se mostró que los antagonistas muscarínicos de acción prolongada (AMAP) son útiles y ahora se los incluye en el tratamiento del asma grave, pero no están aprobados por la Food and Drug Administration para estos casos.
Para el paciente con EPOC “fácil” (véase Cuadro ), también se recomienda un enfoque escalonado, con el objetivo de disminuir los síntomas y las exacerbaciones y reconocer la importancia de las enfermedades coexistentes. Lo principal es el cese del tabaquismo y el empleo de BAAP y AMAP. La función de los glucocorticoides inhalados se discute desde hace años y se limita a los pacientes con enfermedad más grave y a los que sufren exacerbaciones frecuentes.
Pacientes con asma y signos simultáneos de EPOC:
Dada la falta de estudios de intervención aleatorizados sobre el SAOC, es difícil proporcionar orientación sobre el tratamiento para pacientes con el síndrome (Cuadro). Los autores opinan que el tratamiento con glucocorticoides inhalados se debe continuar en pacientes con asma de larga data aunque aparezca un componente de obstrucción irreversible de las vías aéreas; los modificadores del leucotrieno pueden ser valiosos en los pacientes con atopía.
El tratamiento combinado con un BAAP y un AMAP es un enfoque razonable para pacientes con asma o EPOC más grave o con enfermedades superpuestas. No obstante, dado el debate actual sobre la seguridad de los BAAP en personas con asma, cualquier sospecha de un componente asmático debe impulsar el empleo de glucocorticoides inhalados.
Pacientes con EPOC y signos de asma simultánea
Tradicionalmente, la EPOC se caracteriza por antecedentes de tabaquismo, obstrucción persistente y progresiva de las vías respiratorias, falta de reversibilidad de la obstrucción e infiltración neutrofílica en las vías respiratorias. Ahora se sabe que se puede hallar reversibilidad, eosinofilia e hiperreactividad bronquial en pacientes con EPOC.
Los autores opinan que para los pacientes que tienen alguna de estas características tipo asma podrían ser útiles los glucocorticoides inhalados. Este enfoque se debería evaluar en grandes estudios de eficacia con estudio exhaustivo de los fenotipos al inicio. También se necesitan otros parámetros de resultados, ya que los pacientes con EPOC y signos simultáneos de asma quizás no tengan cambios de fácil medición en el VEM1 en respuesta al tratamiento y en un período breve.
Conclusiones
Ya en 1961, una “hipótesis holandesa,” presentada por Orie y colegas, reconocía los problemas para diferenciar entre asma y EPOC. En esta hipótesis pionera se sugería que la expresión clínica del asma y la EPOC en adultos depende de la edad, el sexo y los factores ambientales.
Sobre la base de la información presentada en esta revisión, los autores creen que es prematuro recomendar la designación de SAOC como una entidad en atención primaria o por especialistas. Son necesarias más investigaciones para caracterizar mejor a los pacientes y obtener una definición estandarizada de SAOC basada sobre los marcadores que mejor pronostiquen la respuesta terapéutica en cada paciente. Sugieren que los profesionales sanitarios tengan una historia clínica con mediciones objetivas de cada paciente, que incluya los síntomas, las exacerbaciones, la función pulmonar y la respuesta a los tratamientos. Esperan que estos datos de observación, junto con datos de los estudios a futuro, proporcionen orientación para tratar a pacientes con supuesta superposición de asma y EPOC.
Traducción y resumen objetivo: Dr. Ricardo Ferreira
Autor: Dirkje S. Postma, M.D., Ph.D., and Klaus F. Rabe Fuente: The New England Journal of Medicine The Asthma–COPD Overlap Syndrome
Resumen
El término “síndrome de superposición asma–EPOC” (SAOC) se emplea cuando el paciente tiene características clínicas tanto de asma como de EPOC. En especial en pacientes ancianos, las manifestaciones del asma y la EPOC pueden ser muy similares.
Aún no hay estudios que consideren al SAOC como una entidad. Los autores de este trabajo de revisión creen que es prematuro recomendar la designación de SAOC como una entidad mórbida. Son necesarias más investigaciones para caracterizar mejor a los pacientes y obtener una definición estandarizada de SAOC basada sobre los marcadores que mejor pronostiquen la respuesta terapéutica en cada paciente.
Introducción
Aproximadamente 1 de cada 12 personas en todo el mundo sufre asma o enfermedad pulmonar obstructiva crónica (EPOC).Estas dos entidades, que antes se consideraban como dos enfermedades diferentes, actualmente se reconocen como enfermedades heterogéneas y a menudo superpuestas. El término “síndrome de superposición asma–EPOC” (SAOC) (o ACOS por las sigas del inglés) se emplea cuando una persona tiene características clínicas tanto de asma como de EPOC.
El asma es una enfermedad
inflamatoria que afecta las grandes y pequeñas vías aéreas. Aparece
durante la infancia, a menudo acompañada de alergias, aunque hay un
subgrupo en el que comienza durante la edad adulta. Los pacientes con
asma sufren episodios de disnea, opresión en el pecho, tos y sibilancias
debido a la obstrucción generalizada de las vías respiratorias y la
disminución del flujo espiratorio y del volumen espiratorio máximo en 1
segundo (VEM1) que habitualmente revierte por completo después del
episodio.
"El
término “síndrome de superposición asma–EPOC” se emplea cuando una
persona tiene características clínicas tanto de asma como de EPOC"
La obstrucción de las vías respiratorias se
produce por espasmo del músculo liso, aunque el moco y los infiltrados
inflamatorios también contribuyen. La hiperreactividad bronquial, es
decir el aumento de la respuesta broncoconstrictora a los estímulos
inhalados, es una característica clave del asma, pero no es lo
suficientemente específica como para determinar el diagnóstico.
La EPOC también es una enfermedad inflamatoria de
las vías respiratorias, que afecta en especial la pequeña vía aérea. La
EPOC en general se vuelve sintomática, con disnea, en los mayores de 40 -
45 años y con frecuencia se asocia con tos crónica, flema, sibilancias o
una combinación de éstas. La obstrucción de las vías respiratorias se
produce por contracción del músculo liso, depósito de moco, degradación
tisular o una combinación de estos, con pérdida de la retracción
elástica del pulmón, que genera el cierre de las vías respiratorias.La EPOC, que es progresiva en muchos pacientes, es causada principalmente por el tabaquismo, aunque también la pueden causar el tabaquismo pasivo, la polución ambiental y ciertas exposiciones laborales.
La inflamación de las vías respiratorias es diferente en el asma y en la EPOC. El asma se caracteriza sobre todo por inflamación a predominio de eosinófilos e inflamación que afecta a los linfocitos T auxiliares tipo 2 (Th2).
La EPOC se caracteriza sobre todo por inflamación con abundancia de neutrófilos e inflamación que afecta a los linfocitos CD8. En especial en pacientes ancianos, las manifestaciones del asma y la EPOC pueden ser muy similares. Con el tiempo se desarrolla obstrucción irreversible de las vías respiratorias en algunos pacientes con asma debido a la restructuración de las vías respiratorias, y entonces estos pacientes se asemejan a los que sufren EPOC. En cambio, se puede producir obstrucción de las vías respiratorias reversible en pacientes con EPOC, quienes entonces se asemejarán a los que sufren asma. (Cuadro).
Recientemente, la Global Initiative for Asthma (GINA) y la Global Initiative for Chronic Obstructive Lung Disease (GOLD) publicaron un documento conjunto ( www . ginasthma . org/ local/ uploads/ files/ ACOS_2015 . pdf o www . goldcopd . org/ uploads/ users/ files/GOLD_ACOS_2015 . pdf) que describe al SAOC como una entidad clínica y propone que los médicos reúnan las características del asma y la EPOC que describen al paciente y comparen la cantidad de características que apoyan cada diagnóstico.
En la práctica, si se hallan tres o más características de asma o de EPOC, se sugiere ese diagnóstico; si los números de una y otra son similares, se debe considerar el diagnóstico de SAOC. Las variables importantes son la edad de inicio, las características del comienzo y el curso de los síntomas, los antecedentes personales o familiares, la limitación variable o persistente del flujo aéreo, la función pulmonar entre los síntomas y la distensión pulmonar grave.
Se estima que el SAOC está presente en el 15 - 45% de la población con enfermedad obstructiva de las vías respiratorias y su prevalencia aumenta con la edad. A pesar de esto, no se han efectuado estudios prospectivos doble ciego sobre el tratamiento de estos tipos de pacientes. Es así como no se sabe cuál es el tratamiento más eficaz para los pacientes con SAOC .
En esta revisión, los autores intentan
responder dos preguntas: cómo se determina en un paciente el diagnóstico
de asma, EPOC o SAOC y qué tratamiento deben recibir los pacientes con
SAOC. No hay respuestas basadas en la evidencia para estas preguntas, ya
que aún no hay estudios que consideren al SAOC como una entidad.
Cuadro. Cuatro ejemplos de pacientes con obstrucción de las vías respiratorias*
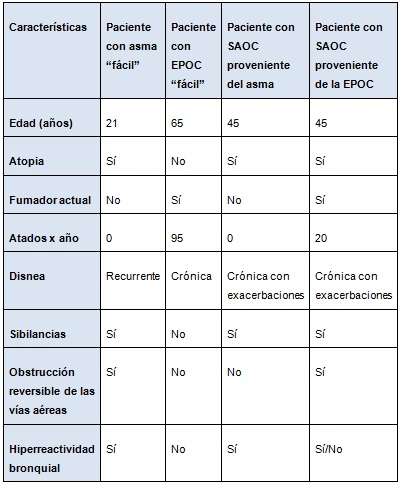
*El “asma fácil” y la “EPOC fácil” son los extremos del asma y la EPOC que se reconocen fácilmente. Los dos pacientes con SAOC tienen edad similar y ambos sufren atopía. A pesar de no ser fumador, el paciente con SAOC proveniente del asma tiene obstrucción de las vías aéreas irreversible, acompañada de disnea crónica y exacerbaciones de las sibilancias y la hiperreactividad bronquial. El paciente con SAOC proveniente de la EPOC tiene cierta reversibilidad de la obstrucción de las vías aéreas tras el empleo de broncodilatadores, disnea crónica y exacerbaciones de las sibilancias, que pueden estar acompañadas o no por hiperreactividad. En ambos pacientes con SAOC, no se puede distinguir con facilidad por su fenotipo si el síndrome proviene del asma o de la EPOC.

*El “asma fácil” y la “EPOC fácil” son los extremos del asma y la EPOC que se reconocen fácilmente. Los dos pacientes con SAOC tienen edad similar y ambos sufren atopía. A pesar de no ser fumador, el paciente con SAOC proveniente del asma tiene obstrucción de las vías aéreas irreversible, acompañada de disnea crónica y exacerbaciones de las sibilancias y la hiperreactividad bronquial. El paciente con SAOC proveniente de la EPOC tiene cierta reversibilidad de la obstrucción de las vías aéreas tras el empleo de broncodilatadores, disnea crónica y exacerbaciones de las sibilancias, que pueden estar acompañadas o no por hiperreactividad. En ambos pacientes con SAOC, no se puede distinguir con facilidad por su fenotipo si el síndrome proviene del asma o de la EPOC.
Obstrucción progresiva de las vías respiratorias:
El pulmón humano crece continuamente hasta la
tercera década de la vida. Esto conduce al aumento de los volúmenes
pulmonares y la mejor función pulmonar, según las mediciones del VEM1. A
partir del comienzo de la edad adulta, el VEM1 disminuye
aproximadamente 25 - 50 ml por año. En pacientes con enfermedad
obstructiva de las vías respiratorias la disminución puede ser mayor —
hasta 80 ml por año en algunos pacientes con asma y hasta 150 ml por año
en algunos pacientes con EPOC. Sin embargo, no hay evidencia
convincente de que la velocidad de disminución del VEM1 se pueda emplear
para distinguir entre el asma y la EPOC.La tendencia mundial al aumento de la expectativa de vida aumenta la mediana de edad de la población con asma. Esto aumenta la probabilidad de superposición con la EPOC, definida por el VEM1; la prevalencia estimada de SAOC depende mucho de la edad. Las poblaciones con antecedentes de asma que pueden tener SAOC son pacientes con asma de larga data y los que sufren asma grave.
Hiperrreactividad bronquial:
La hiperreactividad bronquial se considera como patognomónica del asma. No es parte de la definición de asma, porque no distingue concluyentemente el asma de la EPOC. La hiperreactividad bronquial se origina por numerosos factores, como el diámetro reducido de las vías aéreas, el aumento del grosor de la pared de las vías aéreas, el aumento de la masa muscular lisa y el aumento de la reactividad del músculo liso, el aumento de la vascularidad peribronquial, la pérdida de la retracción elástica del pulmón, la inflamación de las vías aéreas, la lesión del epitelio y el aumento de la actividad neurogénica.
En pacientes con asma hay evidencia de que el grado de hiperreactividad bronquial se relaciona con la inflamación eosinófila subyacente y alteraciones fenotípicas y funcionales del músculo liso de las vías aéreas, alteración de la respuesta glucocorticoide, y disfunción de la pequeña vía aérea. Es discutible si la hiperreactividad bronquial se asocia con la disminución acelerada del VEM1 en pacientes con asma, pero estudios mostraron que la hiperreactividad bronquial disminuyó mucho tras 3 meses de tratamiento con glucocorticoides inhalados, que no es el caso en pacientes con EPOC.
La hiperreactividad bronquial también es un factor de riesgo para el desarrollo de EPOC. Su frecuencia entre pacientes con EPOC es del 60%, y puede aparecer incluso en pacientes con enfermedad leve. Un estudio mostró hiperreactividad bronquial en el 90% de los pacientes con EPOC sin antecedentes de asma. Un estudio reciente mostró que la hiperreactividad bronquial más intensa se asocia con mayor volumen residual (una medida del atrapamiento aéreo relacionado con disfunción de la pequeña vía aérea) en la EPOC.
Además, la hiperreactividad bronquial se asocia con inflamación de las vías respiratorias — es decir, mayores valores de neutrófilos, macrófagos y linfocitos en el esputo y en las muestras de biopsia bronquial y mayores valores de linfocitos CD8 y eosinófilos en los tejidos pulmonares periféricos — en pacientes con EPOC. Antes se pensaba que la asociación de aumento de eosinófilos con hiperreactividad bronquial se limitaba sólo al asma.
¿Cuáles son las consecuencias clínicas de la hiperreactividad bronquial en la EPOC?
Estudios mostraron que la disminución del VEM1 se acelera en pacientes con EPOC que tienen hiperreactividad bronquial y que la disminución es mayor aún en los fumadores. Así, la asociación de la hiperreactividad bronquial con la evolución de los cambios de la función pulmonar y con la respuesta a los glucocorticoides inhalados difiere entre la EPOC y el asma.
La hiperreactividad bronquial es un factor de riesgo de muerte por EPOC en la población general. Por ello, la hiperreactividad bronquial es un marcador de enfermedad más grave tanto en el asma como en la EPOC, pero no hay datos suficientes para indicar beneficios alejados con la reducción de la hiperreactividad bronquial, y, de ser así, cómo lograr esto en pacientes que sufren tanto asma como EPOC.
Reversibilidad de la obstrucción de las vías respiratorias:
La reversibilidad de la obstrucción de las vías respiratorias tras la inhalación de un broncodilatador como el albuterol es patognomónica del asma temprana y se la considera como criterio para diferenciar el asma de la EPOC. La reversibilidad puede disminuir o incluso desaparecer con el asma de larga data. Es bien sabido que la función pulmonar se puede normalizar tras la inhalación de broncodilatadores o tras el empleo de glucocorticoides inhalados en formas de asma más leves. En cambio, en el asma más grave, la reversibilidad puede ser limitada; es decir que la falta de reversibilidad total no descarta el diagnóstico de asma.
Con frecuencia también hay reversibilidad de la obstrucción de las vías respiratorias en la EPOC; en dos estudios, se observó reversibilidad en hasta el 44%de los pacientes en uno y el 50% en el otro.
La atopía en el asma y en la EPOC:
La atopía es un factor de riesgo para el asma y la mayoría de las personas con asma son atópicas. El asma alérgica generalmente responde al tratamiento con glucocorticoides inhalados. Los pacientes con EPOC también pueden ser atópicos e incluso es un factor de riesgo para el desarrollo de EPOC. Dos estudios que investigaron la presencia de atopía en cohortes de personas con EPOC mostraron prevalencias del 18% y el 30%, respectivamente.
The European Respiratory Society Study on Chronic Obstructive Pulmonary Disease (EUROSCOP) es un estudio prospectivo aleatorizado, controlado, de la eficacia a largo plazo, de los glucocorticoides inhalados en la EPOC de leve a moderada. Este estudio mostró que aproximadamente el 18% de los pacientes eran atópicos.
La atopía no se asoció significativamente con la gravedad basal de la obstrucción de las vías respiratorias o la velocidad de la diminución del VEM1, pero sí con tos y flemas en los pacientes que recibían placebo. Los pacientes con atopía que recibieron budesonida tuvieron menos de estos síntomas que aquéllos sin atopía. Esta observación coincide con los resultados de un estudio anterior que sugirió que los pacientes con EPOC que sufren atopía son los que más se benefician con los glucocorticoides.
Inflamación de las vías respiratorias en el asma y EPOC:
Se acepta que el asma típicamente tiene un patrón de inflamación eosinófílo y de citocinas producidas por las Th2, mientras la inflamación neutrófila domina en la EPOC. Pacientes con asma que sufren enfermedad grave o de inicio tardío o infecciones crónicas o que fuman también pueden mostrar inflamación neutrófila y células CD8 en las vías aéreas, mientras que antes se creía que ambas eran patognomónicas de la EPOC. Debido a que el número de neutrófilos en las vías respiratorias aumenta con la edad, este patrón inflamatorio puede simular EPOC en personas ancianas con asma.
Datos recientes sugieren que el reclutamiento de eosinófilos depende de varias vías que no son la clásica vía de Th2 — vías que implican las células linfoideas innatas tipo 2, la interleucina-33, la GATA-3 y los receptores para CRTH2. Es importante observar que la ausencia de eosinofilia y la falta de respuesta a los glucocorticoides inhalados en un paciente no descartan el asma.
La expresión genética distintiva de inflamación de Th2 se puede hallar también en la EPOC. Por ejemplo, la interleucina-13 (una citocina Th2) se expresó en más células T en el líquido de lavado broncoalveolar en pacientes con EPOC que en aquéllos sin EPOC. En un subgrupo de pacientes con EPOC, la expresión genética distintiva de inflamación de Th2 aumentó en muestras de biopsia de las paredes de las vías aéreas, igual que en los pacientes con asma.
Estas características de la expresión del gen se asociaron también con inflamación eosinofílica en la EPOC. El perfil Th2, sin embargo, no se asoció con una respuesta del VEM1 a los glucocorticoides inhalados, como en el asma, sino con la disminución de la relación volumen residual/capacidad pulmonar total, un marcador de hiperinsuflación.
En el 15 - 40% de los pacientes con EPOC estable se hallan eosinófilos en el esputo, el lavado broncoalveolar y el tejido pulmonar. La activación de los eosinófilos se asocia con la gravedad de la enfermedad. Los eosinófilos también pueden aumentar en el esputo de los pacientes con exacerbaciones de la EPOC. En el estudio ECLIPSE, el 37,4% de los 1483 pacientes con EPOC tuvieron eosinofilia persistente en sangre (>2%) durante 3 años de seguimiento.
En otro estudio, los pacientes con EPOC que tenían mayor eosinofilia, aunque la mayoría dentro de lo normal, mantuvieron los valores de VEM1 durante el seguimiento, mientras que aquéllos con valores de eosinófilos menores tuvieron disminuciones aceleradas en el VEM1 posbroncodilatador.
Los pacientes con asma o EPOC que tienen eosinofilia en el esputo tienen mejor respuesta a los glucocorticoides inhalados que aquéllos sin eosinofilia. El tratamiento con glucocorticoides inhalados para reducir la eosinofilia en pacientes con EPOC previene las exacerbaciones y las hospitalizaciones y los glucocorticoides son eficaces para tratar las exacerbaciones que se acompañan con eosinofilia. Estos datos sugieren que la inflamación eosinófila en sangre, esputo o tejido pulmonar significa un endotipo de EPOC con enfermedad más grave, que se refleja en las exacerbaciones, pero menos grave cuando se la evalúa según la disminución del VEM1.
Oxido nítrico exhalado en el asma:
El óxido nítrico exhalado (FeNO) puede ser útil para el diagnóstico de asma. Los valores de FeNO son menores en fumadores que en no fumadores y por eso las determinaciones de FeNO no son tan útiles para diferenciar el asma de la EPOC. Las cifras de FeNO se asocian con eosinofilia en esputo y sangre en el asma; no se sabe si esto es así en la EPOC. Aunque los valores de FeNO en pacientes con asma pueden disminuir notablemente tras el tratamiento con glucocorticoides inhalados, algunos pacientes tienen aumentos persistentes a pesar de este tratamiento. En estos casos puede haber vías operativas distintas a la clásica vía de los Th2.
¿Es el SAOC importante para la práctica médica?
Aunque las superposiciones entre asma y EPOC constituyen una realidad, los documentos GINA y GOLD no proporcionaron una definición específica de SAOC y afirmaron que es necesaria más evidencia sobre “fenotipos clínicos y mecanismos subyacentes”. El peligro de considerar que el SAOC es una entidad mórbida es que se pueden borronear los límites entre asma y EPOC, porque no existen investigaciones que estudien específicamente la población con SAOC, o que puede generar sobretratamiento, en especial con glucocorticoides inhalados.
Otro problema es que se aplican diferentes definiciones de SAOC en diversos estudios. Se impiden así conclusiones firmes sobre la gravedad, el tratamiento y el pronóstico del mismo. Por eso es casi imposible determinar el tratamiento más eficaz para cada paciente. Los autores sugieren la caracterización fenotípica exhaustiva de cada paciente antes de incluirlos en los estudios.
Tratamiento actual del asma y la EPOC
Los documentos GINA y GOLD proporcionan planes terapéuticos bien definidos para los casos claros de asma y EPOC. Por ejemplo, para el paciente con asma “fácil” (véase Cuadro arriba), se recomienda un enfoque escalonado sobre la base de la gravedad de la enfermedad, con el objetivo de mejorarla y de controlar el riesgo a futuro. Los pilares del tratamiento son los glucocorticoides inhalados junto con broncodilatadores, en especial beta-agonistas de acción corta y beta- agonistas de acción prolongada (BAAP). Los antagonistas de los receptores de leucotrieno son otra alternativa cuando la enfermedad es más leve.
Para el asma alérgica grave con valores apropiados de IgE, el tratamiento anti-IgE es una opción aprobada. En estudios controlados se mostró que los antagonistas muscarínicos de acción prolongada (AMAP) son útiles y ahora se los incluye en el tratamiento del asma grave, pero no están aprobados por la Food and Drug Administration para estos casos.
Para el paciente con EPOC “fácil” (véase Cuadro ), también se recomienda un enfoque escalonado, con el objetivo de disminuir los síntomas y las exacerbaciones y reconocer la importancia de las enfermedades coexistentes. Lo principal es el cese del tabaquismo y el empleo de BAAP y AMAP. La función de los glucocorticoides inhalados se discute desde hace años y se limita a los pacientes con enfermedad más grave y a los que sufren exacerbaciones frecuentes.
Pacientes con asma y signos simultáneos de EPOC:
Dada la falta de estudios de intervención aleatorizados sobre el SAOC, es difícil proporcionar orientación sobre el tratamiento para pacientes con el síndrome (Cuadro). Los autores opinan que el tratamiento con glucocorticoides inhalados se debe continuar en pacientes con asma de larga data aunque aparezca un componente de obstrucción irreversible de las vías aéreas; los modificadores del leucotrieno pueden ser valiosos en los pacientes con atopía.
El tratamiento combinado con un BAAP y un AMAP es un enfoque razonable para pacientes con asma o EPOC más grave o con enfermedades superpuestas. No obstante, dado el debate actual sobre la seguridad de los BAAP en personas con asma, cualquier sospecha de un componente asmático debe impulsar el empleo de glucocorticoides inhalados.
Pacientes con EPOC y signos de asma simultánea
Tradicionalmente, la EPOC se caracteriza por antecedentes de tabaquismo, obstrucción persistente y progresiva de las vías respiratorias, falta de reversibilidad de la obstrucción e infiltración neutrofílica en las vías respiratorias. Ahora se sabe que se puede hallar reversibilidad, eosinofilia e hiperreactividad bronquial en pacientes con EPOC.
Los autores opinan que para los pacientes que tienen alguna de estas características tipo asma podrían ser útiles los glucocorticoides inhalados. Este enfoque se debería evaluar en grandes estudios de eficacia con estudio exhaustivo de los fenotipos al inicio. También se necesitan otros parámetros de resultados, ya que los pacientes con EPOC y signos simultáneos de asma quizás no tengan cambios de fácil medición en el VEM1 en respuesta al tratamiento y en un período breve.
Conclusiones
Ya en 1961, una “hipótesis holandesa,” presentada por Orie y colegas, reconocía los problemas para diferenciar entre asma y EPOC. En esta hipótesis pionera se sugería que la expresión clínica del asma y la EPOC en adultos depende de la edad, el sexo y los factores ambientales.
Sobre la base de la información presentada en esta revisión, los autores creen que es prematuro recomendar la designación de SAOC como una entidad en atención primaria o por especialistas. Son necesarias más investigaciones para caracterizar mejor a los pacientes y obtener una definición estandarizada de SAOC basada sobre los marcadores que mejor pronostiquen la respuesta terapéutica en cada paciente. Sugieren que los profesionales sanitarios tengan una historia clínica con mediciones objetivas de cada paciente, que incluya los síntomas, las exacerbaciones, la función pulmonar y la respuesta a los tratamientos. Esperan que estos datos de observación, junto con datos de los estudios a futuro, proporcionen orientación para tratar a pacientes con supuesta superposición de asma y EPOC.
Traducción y resumen objetivo: Dr. Ricardo Ferreira

No hay comentarios:
Publicar un comentario