jueves, 10 de octubre de 2013
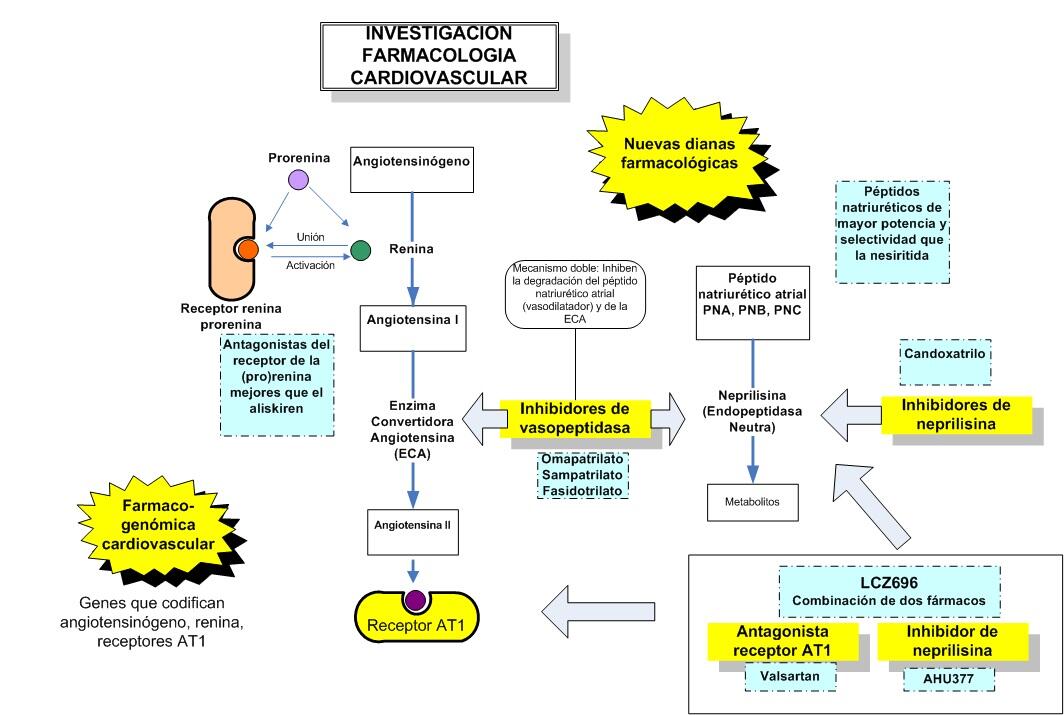
IC: No más de 2 inhibidores SRAA --> Riesgo hiperpotasiemia y arritmias.Vigilar interacciones k+
BMJ. 2003 19 de julio, 327 (7407) : 147-149.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1126510/
Conclusión
Al parecer, existen condiciones que pueden llevar al desarrollo de hiperpotasemia grave en los pacientes con insuficiencia cardíaca que toman espironolactona e inhibidores de la ECA o AT 1 bloqueadores del receptor: edad avanzada, la dosis de espironolactona> 25 mg al día, función renal reducida, y la diabetes mellitus tipo 2. Concentración de potasio en plasma debe controlarse con frecuencia en estos pacientes, en los que se recomienda que la dosis de espironolactona debe limitarse a 25 mg al día o incluso cada dos días. Una prueba de la función renal (por lo menos mediante la aplicación de la fórmula de Cockroft y Gault) antes de iniciar el tratamiento es útil como una concentración de creatinina en plasma <221 mmol / l NO excluye los pacientes con insuficiencia renal. Hiperpotasemia no detectada puede sospechar una posible causa de muerte súbita en algunos pacientes tratados por insuficiencia cardíaca con espironolactona y los inhibidores de la ECA o AT 1 bloqueadores de los receptores.
¿Me tomo el yogur o el medicamento?: claves en la regulación de los alimentos funcionales. Blog de la Sociedad Española de Farmacéuticos de Atención Primaria
Estoy convencido de que más de uno de vuestros pacientes o de las personas de vuestro entorno, se ha hecho esta pregunta, sobre todo ahora que el mismísimo Don Vicente del Bosque ha prestado su imagen en un anuncio publicitario que nos cuenta las bondades de un alimento para reducir el temido colesterol.
 Para controlar la avalancha de declaraciones y funcionalidades atribuidas a determinados alimentos por sus fabricantes, se redactó elReglamento 1924/2006 del Parlamento Europeo y del Consejo, de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos; es la norma que ha sentado las bases legales para este tipo de alimentos.
Para controlar la avalancha de declaraciones y funcionalidades atribuidas a determinados alimentos por sus fabricantes, se redactó elReglamento 1924/2006 del Parlamento Europeo y del Consejo, de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos; es la norma que ha sentado las bases legales para este tipo de alimentos.
La principal finalidad del Reglamento 1924/2006 es garantizar un elevado nivel de protección del consumidor introduciendo la evaluación científica en seno de la EFSA (Agencia Europea de Seguridad Alimentaria) como requisito previo para poder realizar unadeclaración nutricional o de propiedades saludables, manteniendo los principios generales de la legislación comunitaria en materia de etiquetado, presentación y publicidad de los productos alimenticios, que prohíbe de forma general el uso de información que pueda inducir a error al comprador o que atribuya propiedades preventivas o curativas a los alimentos.
Sólo se autorizará la declaración cuando:
- Se ha demostrado científicamente un efecto beneficioso derivado de la presencia, ausencia o contenido reducido de la sustancia sobre la que se hace la declaración.
- La sustancia objeto de declaración está presente en una cantidad significativa para producir el efecto beneficioso.
- La sustancia objeto de la declaración está ausente o se ha reducido en una cantidad suficiente para justificar el efecto beneficioso.
- La sustancia objeto de declaración se encuentra en una cantidad asimilable por el organismo.
- La cantidad de producto que razonablemente pueda consumirse aporta la cantidad necesaria (del componente objeto de la declaración) para producir el efecto beneficioso.
- El consumidor medio puede entender la declaración.
- La declaración hace referencia a los alimentos listos para su consumo.
Deben distinguirse las siguientes categorías de declaraciones que se indican a continuación.
1.- DECLARACIONES NUTRICIONALES O DE CONTENIDO
Según el Reglamento, se entenderá por «declaración nutricional» cualquier declaración que afirme, sugiera o dé a entender que un alimento posee propiedades nutricionales benéficas específicas con motivo de su aporte energético, o de las características de sus nutrientes.
Por ejemplo, en esta categoría de declaraciones estarían las menciones como: «bajo en calorías, sal o azúcar» o «rico en vitaminas, fibra o proteínas».
Según el artículo 8 del Reglamento 1924/2006, solamente se autorizarán las declaraciones nutricionales si están enumeradas en su Anexo y se ajustan a las condiciones fijadas en el mismo.
2.- LAS DECLARACIONES DE PROPIEDADES SALUDABLES
Son las que dan a entender que existe una relación entre una categoría de alimentos, un alimento o uno de sus componentes y la salud. En concreto, este tipo de declaraciones son aquellas que describen o se refieren a:
- La función de un nutriente o de otra sustancia en el crecimiento, el desarrollo y las funciones corporales, o
- las funciones psicológicas y comportamentales, o
- el control de peso, la disminución de la sensación de hambre, el aumento de la sensación de saciedad, o la reducción del aporte energético de la dieta, teniendo en cuenta lo dispuesto en su normativa específica (Reglamento 609/2013);
Con la entrada en vigor del reglamento, se acordó la publicación de una lista comunitaria de declaraciones de las propiedades saludables distintas de las relativas a la reducción del riesgo de enfermedad y al desarrollo y salud de los niños, y todas las condiciones de uso, que finalmente fue publicada en mayo de 2012, para que las empresas pudieran acogerse a ellas.
La lista elaborada por la Comisión finalmente contiene 222 declaraciones de propiedades saludables que se publicaron en el Reglamento 432/2012.
3.- LAS DECLARACIONES ESPECÍFICAS DE REDUCCIÓN DEL RIESGO DE ENFERMEDAD Y DECLARACIONES RELATIVAS AL DESARROLLO Y LA SALUD DE LOS NIÑOS.
Este tipo de declaraciones deben ser autorizadas por la Comisión Europea y publicadas en una lista comunitaria de declaraciones permitidas como condición previa a su utilización.
Estas declaraciones se clasifican de la siguiente forma:
- Relativas a la reducción de factor de riesgo de una enfermedad, es cualquier declaración de propiedades saludables que afirme, sugiera o dé a entender que el consumo de una categoría de alimentos, un alimento o uno de sus constituyentes reduce significativamente un factor de riesgo de aparición de una enfermedad humana.
- Relativas al desarrollo y salud de los niños
En estos casos, el grupo de trabajo sobre productos dietéticos, nutrición y alergias de EFSA, evalúa la sustentación científica que apoya a las solicitudes, emitiendo una opinión que servirá de base a la Comisión Europea y a los Estados Miembros, en los siguientes pasos que son la posible autorización o denegación de las mencionadas solicitudes.
El factor clave reside en que los alimentos que realicen declaraciones de reducción del riesgo de enfermedad deben, además de cumplir los requisitos generales de etiquetado establecidos en el Reglamento, incluir las advertencias siguientes:
- Una indicación de que la enfermedad a la que se refiere la declaración posee múltiples factores de riesgo.
- La alteración de uno de estos factores de riesgo puede tener o no un efecto beneficioso.
Es interesante conocer que todos los resultados de las evaluaciones están publicadas en la una sección de la página web de la EFSA; allí se pueden las declaraciones autorizadas y las denegadas, junto con un amplio detalle de los documentos aportados que han sido evaluados para tomar la decisión. De todos ellos he seleccionado una evaluación sobreglucosamina clorhidrato, que fue denegada ¿os suena de algo?.
Con respecto al Danacol®, de acuerdo con la opinión del panel de expertos, tiene autorizada su declaración en los siguientes términos: “Los fitosteroles han demostrado disminuir / reducir el colesterol en la sangre. El colesterol alto es un factor de riesgo en el desarrollo de la enfermedad coronaria”. Del mismo modo, el panel considera que este producto debería ser consumido por personas que, teniendo altos niveles de colesterol en sangre, necesitan y además desean reducirlos. Por último indican que, en los pacientes en tratamiento con hipolipemiantes, solo se debe consumir este producto bajo supervisión médica.
Conviene dejar claro que en la recomendación se distingue entre personas sanas y personas bajo tratamiento. Además, esta autorización es válida solo para un producto concreto, no siendo extrapolable a las marcas blancas que se pudieran encontrar en la estantería cercana del supermercado. En este caso, no existen criterios de intercambiabilidad basados en la composición cuali y cuantitativa de fracción terapéutica, tal como ocurre con los medicamentos.
En necesario un control más riguroso del mensaje publicitario y de su adecuación a la declaración autorizada porque, en no pocas ocasiones puede confundir al público en general. Lo que está claro es que las declaraciones autorizadas están destinadas a factores de riesgo, que pueden jugar o no, un papel relevante en patologías concretas. Ello les prohíbe expresamente atribuirse propiedades terapéuticas: eso queda para la liga de los medicamentos.
En conclusión, las declaraciones que acompañan a determinados alimentos están bien reguladas en la Unión Europea y, sin que se les puedan atribuir propiedades preventivas o curativas, se les exige una justificación científica que requiere evaluación por comités de la EFSA.
Si quieres profundizar más en este tema haz click en este enlace.
Entrada elaborada por José Manuel Paredero.
Calidad de los informes de alta hospitalaria respecto a la legislación vigente y las recomendaciones consensuadas por expertos, Gaceta Sanitaria
Objetivos
Conocer la calidad de los informes de alta hospitalaria respecto a la legislación vigente y el consenso para la elaboración de informes de alta hospitalaria en especialidades médicas en 11 hospitales de Andalucía.
Material y métodos
Estudio transversal de 1708 informes de alta hospitalaria. Analizamos la presencia o no de los diferentes ítems requeridos tanto por la legislación actual como por las recomendaciones del consenso.
Resultados
El 97,4% (intervalo de confianza del 95% [IC95%]: 96,5-98,2) de los informes de alta hospitalaria fueron catalogados como adecuados si nos ajustamos a los requisitos que contempla la legislación vigente. Si la evaluación era respecto al consenso, el porcentaje de adecuación descendía al 72,1% (IC95%:70,0-74,3). Destaca la ausencia de la duración del tratamiento tras el alta en el 39,4% de los informes.
Conclusiones
Los informes de alta hospitalaria ofrecen un excelente grado de cumplimentación de los datos exigidos por la normativa vigente, pero deben mejorar en su calidad intrínseca.
Artículo
Suscribirse a:
Comentarios (Atom)